|
|
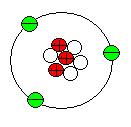
Le Lithium
Elément chimique blanc argenté, symbole Li et numéro atomique 3. C'est le plus léger de tous les métaux. C’est le premier métal alcalin. Il a été découvert par Johann August Arfvedson, en 1817. Le lithium constitue seulement de 0,003 à 0,005 % de l’écorce terrestre. Il n’existe pas dans la nature à l’état libre, mais seulement sous forme de dérivés largement répandus. Les principaux minerais sont des silicates contenant également de l’aluminium, comme le mica lépidolite ou le pyroxène triphane, minerai le plus abondant, et des phosphates, comme l’amblygonite. On trouve les principaux gisements de spodumène, silicate d’aluminium et de lithium, en ex-URSS, au Zimbabwe et en Chine. Propriétés À l’état naturel, le lithium est un mélange des isotopes 6Li (12 %) et 7Li. Il cristallise dans le système cubique. C’est le plus léger des solides et le plus dur des métaux alcalins. Mais c’est un métal mou : il est rayé par le plomb. Chimiquement, le comportement du lithium s’apparente à celui du sodium : il forme essentiellement des composés ioniques. Comme les autres métaux alcalins, il s’allie à l’hydrogène pour former l’hydrure LiH, résistant aux températures élevées. Il réduit de nombreux oxydes. En présence de fluor, il s’enflamme à température ambiante. Le lithium fond à 180!°C, bout vers 1 330!°C!; sa densité est de 0,53 et sa masse atomique est égale à 6,941. Production et Utilisations Il est uniquement obtenu par électrolyse d’un mélange de chlorures de lithium et de potassium fondus. Le métal brut est ensuite purifié par distillation moléculaire. Il ternit instantanément et se corrode rapidement à l’air. Il doit donc être stocké dans un liquide inerte, tel que le naphta. Les principaux producteurs de lithium sont l’ex-URSS, le Zimbabwe, la Chine, les États-Unis et certains États sud-américains. Il est utilisé comme antioxydant et pour supprimer les gaz indésirables qui se forment pendant la fusion des métaux non ferreux. Sa vapeur sert à éviter la formation de dépôts dus au dioxyde de carbone et à l’oxygène, dans les fours de traitement thermique de l’acier. L’hydroxyde de lithium, permet de capter le dioxyde de carbone dans les ventilateurs des vaisseaux spatiaux et des sous-marins. L’hydrure est employé comme source d’hydrogène, pour gonfler les canots de sauvetage!; son équivalent deutéré est utilisé dans la fabrication de la bombe à hydrogène. En médecine, on emploie le carbonate de lithium, composé minéral courant, dans le traitement des psychoses maniaco-dépressives .
|
|
||
|
|
|
|||
|
|