|
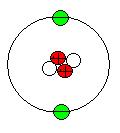
Hélium
(du grec hêlios, Soleil), gaz rare, inerte, incolore, inodore. son numéro atomique est 2. L'astronome français Pierre Janssen découvrit l'hélium dans le spectre de la couronne solaire, pendant une éclipse, en 1868. Peu de temps après, ce corps fut identifié comme un élément et dénommé par le chimiste britannique sir Edward Frankland, et par l'astronome britannique sir Joseph Norman Lockyer. Le gaz fut isolé pour la première fois d'une source terrestre en 1895 par le chimiste britannique sir William Ramsay, qui l'a découvert dans la clévéite, composé minéral contenant de l'uranium. En 1907, le physicien britannique sir Ernest Rutherford montra que les particules alpha étaient des noyaux de l'atome d'hélium. Ses propriétés L'hélium est constitué de molécules monoatomiques !; c'est le plus léger des gaz après l'hydrogène. Il se solidifie à -272,2°C à des pressions supérieures à 25 atm!, a une densité de 0,1664 à 20°C et sa masse atomique est de 4,003. Comme les autres gaz rares, ou nobles, l'hélium est inerte chimiquement. Sa seule couche électronique est remplie ce qui rend très difficile les réactions avec d'autres éléments et les composés qui en sont issus instables. Des composés avec le néon, un autre gaz rare, et avec l'hydrogène ont été découverts. Du fait de l'abondance de l'hélium dans l'univers, l'existence de telles réactions, bien que rares, peut être importante ..L'hélium est le plus difficile des gaz à liquéfier!; il est impossible à solidifier à des pressions atmosphériques ordinaires. Ces propriétés le rendent très utile comme réfrigérant et pour obtenir et mesurer des températures proches du zéro absolu. L'hélium liquide peut être refroidi pratiquement au zéro absolu à pression normale, par une extraction rapide de la vapeur au-dessus du liquide. À une température légèrement supérieure au zéro absolu, l'hélium se transforme en hélium II, liquide qui possède des propriétés physiques uniques : il n'a pas de température de fusion, sa viscosité est apparemment nulle, il passe facilement à travers les fissures et les pores de très petites dimensions, monte même le long des parois du récipient qui le contient. L'hélium-3, isotope le plus léger de l'hélium, de masse atomique 3, a une température d'ébullition encore plus basse que l'hélium ordinaire et présente des propriétés différentes lorsqu'il est liquéfié. L'hélium est l'élément le plus abondant de l'Univers après l'hydrogène. Au niveau de la mer, il est présent dans une proportion de 5,4 parties par million de l'atmosphère terrestre, proportion qui augmente légèrement avec l'altitude. Environ 1 partie par million de l'hélium atmosphérique est constituée d'hélium-3, produit de décomposition du tritium, isotope radioactif de l'hydrogène de masse 3. L'isotope ordinaire de l'hélium, l'hélium-4, a pour origine probable des émetteurs alpha radioactifs situés dans des roches. Le gaz naturel, qui contient en moyenne 0,4 % d'hélium, en est la plus importante source industrielle. Ses utilisations Étant incombustible et ayant 92 % de la puissance de poussée de l'hydrogène et bien que deux fois plus lourd, on le préfère à ce gaz pour soulever les dirigeables. Il est utilisé pour pressuriser et renforcer la structure des fusées avant le décollage. Il permet également de pressuriser les réservoirs d'hydrogène liquide ou des autres combustibles pour forcer leur introduction dans les moteursparcequ'il reste gazeux même à la basse température de l'hydrogène liquide. On pourrait utiliser l'hélium comme échangeur de chaleur dans les réacteurs nucléaires, car il reste chimiquement inerte et est non radioactif.Ilest utilisé comme gaz de soudure des métaux légers, tels que les alliages d'aluminium et de magnésium qui, autrement, s'oxyderaient, en protégeant les parties chaudes d'une réaction avec l'air. Il est aussi utilisé pour remplacer l'azote dans l'atmosphère synthétique des plongeurs . Cette atmosphère synthétique est utilisée en médecine pour soulager les difficultés respiratoires, l'hélium pénètrant plus facilement que l'azote dans les voies respiratoires rétrécies.
|
|
||