|
|
Le Carbone
 |
|
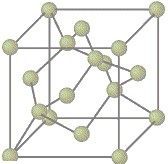
Le Diamant, c'est du Carbone |
Symbole C, il est nécessaire à
l'existence des organismes vivants et a de nombreuses applications .
Numéro atomique 6. L'élément appartient au groupe 14 du tableau
périodique et sa masse atomique est de 12,01.
Structure et propriétés
Les trois formes
allotropiques du carbone sont : — diamant,
graphite et carbone amorphe — Ce sont des solides avec des points de
fusion extrêmement élevés et insolubles dans tous les solvants à
température ambiante. Les propriétés physiques des trois formes diffèrent
largement en raison des différences dans la structure cristalline. Dans le
diamant, matière la plus dure que l'on connaisse, chaque atome de carbone
est lié à quatre autres atomes dans une structure régulière à trois
dimensions, tandis que le graphite est constitué de couches d'atomes
planes et parallèles et les atomes forment des hexagones réguliers et
faiblement reliés. Le carbone amorphe est caractérisé par un très
faible degré de cristallinité. Il peut être obtenu en chauffant du sucre
purifié à 900!°C en l'absence d'air.
Il a
la possibilité de se lier à d'autres atomes de carbone pour former des
chaînes et des cycles complexes. Cette propriété justifie le grand nombre
de composés. Les premiers composés furent identifiés dans la matière
vivante au début du XIXe siècle.
L'étude des composés du carbone fut ainsi appelée !chimie organique!.
Aux températures ambiantes,
le carbone est caractérisé par une faible réactivité. Aux températures
élevées, il réagit spontanément avec la plupart des métaux pour former des
carbures et avec l'oxygène pour former le monoxyde de carbone (CO) et le
dioxyde de carbone (CO2). Sous forme de coke, il est utilisé pour éliminer
l'oxygène des minerais d'oxydes de métaux afin d'obtenir le métal pur. Le
carbone forme aussi des composés avec la plupart des éléments non
métalliques, bien que certains, comme le tétrachlorure de carbone (CCl4),
doivent être synthétisés par un procédé indirect. En général, le carbone a
une valence de 4 dans ses composés.
Origine et
utilisations
Le carbone est largement
répandu dans la nature, bien qu'il représente seulement 0,025 %
de la croûte terrestre. Il y apparaît principalement sous forme de
carbonates. Le dioxyde de carbone est un constituant important de
l'atmosphère : c'est la principale source de carbone pour la matière
vivante. Les plantes, en utilisant la photosynthèse, transforment le
dioxyde de carbone en composés organiques, qui sont consommés ensuite par
d'autres organismes
Le
carbone amorphe est présent à différents degrés de pureté dans le charbon
de bois, la houille, le coke, le noir de carbone et le noir de fumée. Le
noir de fumée est synthétisé en calcinant des hydrocarbures liquides,
comme le kérosène, avec une quantité d'air insuffisante pour produire une
flamme avec fumée. La fumée est recueillie dans une chambre séparée.
Pendant longtemps, le noir de fumée a été utilisé comme pigment noir dans
les encres et les peintures, puis il a été remplacé par le noir de
carbone, constitué de particules plus fines. Le noir de carbone est
produit par la combustion incomplète du gaz naturel et est principalement
utilisé comme charge et comme renfort dans le caoutchouc. En 1985,
des scientifiques vaporisèrent du graphite et obtinrent une forme stable
de molécule de carbone contenant 60 atomes arrangés en une forme
sphérique, semblable à un ballon de football.
Applications
scientifiques
L'isotope du carbone le
plus courant est le carbone 12,
stable. En 1961, cet isotope fut choisi pour remplacer l'oxygène 16 comme
standard pour les masses atomiques et fut affecté de la masse atomique 12.
Les
isotopes carbone 13
et carbone 14 sont radioactifs et sont largement utilisés comme traceurs
isotopiques en recherche biochimique. Le carbone 14 est également employé
dans la technique de datation par radiocarbone , qui permet d'évaluer
l'âge des fossiles et d'autres matières organiques. Le carbone 14 est
continuellement produit dans l'atmosphère par les rayons cosmiques et est
contenu dans toute matière vivante. Le carbone 14 a une période
radioactive de 5 760 années. Le rapport entre le carbone 14 et le carbone 12
présents dans un échantillon donné permet de mesurer son âge approximatif.
Le carbone est également utilisé pour former les fibres de carbone,
renfort de certains matériaux composites. En effet, la fibre de carbone
présente une résistance mécanique élevée.
RETOUR AU TABLEAU
RETOUR AUX
DOSSIERS
|
|